연료전지 작동원리 |
|||||
|---|---|---|---|---|---|
| 작성자 | 임흥빈 | 등록일 | 06.03.17 | 조회수 | 320 |
| 첨부파일 | |||||
|
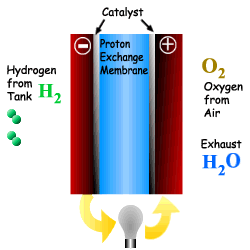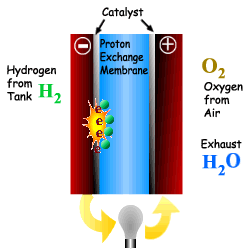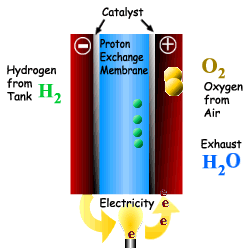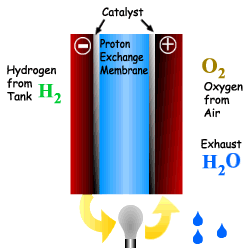
위의 그림에서 보는 바와 같이 수소는 Anode를 통과하고 산소는 Cathode를 통과한다. 수소는 전기 화학적으로 산소와 반응하여 물을 생성하면서 전극에 전류를 발생시킨다. 전자가 전해질을 통과하면서 직류 전력이 발생하며 열도 부수적으로 생산된다. 직류 전류는 직류 전동기의 동력으로 사용되거나 인버터에 의해 교류 전류로 바꾸어 사용된다. 연료전지에서 발생된 열은 개질을 위한 증기를 발생시키거나 냉난방 열로 사용될 수 있으며, 사용되지 않을 경우에는 배기열로 배출된다.
연료전지의 연료인 수소는 순수 수소를 이용하거나, 메탄이나 에탄올 같은 탄화수소를 이용하여 개질이라는 과정을 통해 생산된 수소를 이용한다. 순수한 산소는 연료전지의 효율을 높일 수 있지 만 산소 저장에 따른 비용과 무게가 증가하는 문제가 있다. 따라서 공기 중에 산소가 많이 포함되어 있으므로 효율은 좀 떨어지지만 공기를 직접 이용한다. 종합적으로 다음과 같은 반응에 따라 전기와 열 및 물이 생성된다. Anode : H2 -→ 2H+ + 2e- Cathode : O2 + 2H+ + 2e- -→ H2O Overall : H2 + O2 -→ H2O + 전류 + 열 전해질은 한 전극에서 다른 전극으로 수소 이온을 전달해 주는 역할을 한다. 이온전달의 저항을 최소화 해주기 위하여 전해질막은 전극이 접촉되지 않는 범위에서 가능한 얇게 한다. 촉매는 전극 의 반응을 향상시킨다. 2개의 전극으로 구성된 단위 셀은 이론적으로 전압을 1.23Volt 까지 생성시킬 수 있으나, 실제는 0.7V 정도를 생산한다. 연료전지는 필요한 전압을 위하여 겹층으로 구성한다. 요구되는 출력을 얻기 위해 표준 크기의 스택을 직렬로 연결하여 상용연료전지를 구성한다 |
|||||
| 이전글 | 타워크레인 높이조절 원리 |
|---|---|
| 다음글 | 데이터베이스 필터링 자료 |